Nombre d'électrons externes de chaque atome: |
H : 1 C : 4 O : 6 |
Nombre total d'électrons externes: |
20 électrons
|
Nombre de doublets à répartir dans la molécule: |
10 doublets d'électrons
|
||
Deuxième solution : |
|||
Formule de Lewis de la molécule: |
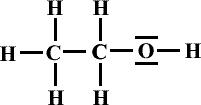 |
Formule de Lewis de la molécule: |
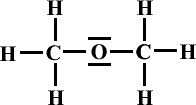 |
Formule semi-développée : |
|
Formule semi-développée : |
|
Nom : |
Ethanol |
Nom : |
Méthoxyméthane |