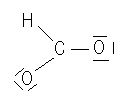
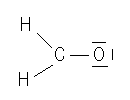
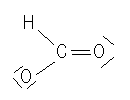
Description des atomes
Ci-dessous les données utiles pour les questions 1 à 10
Particule |
Symbole |
Charge électrique |
Masse |
Proton |
p+ (ou p) |
+ 1,6 . 10-19 C |
1,67 . 10-27 kg |
Neutron |
n0 (ou n) |
0 |
1,67 . 10-27 kg |
Electron |
e- |
- 1,6 . 10-19 C |
9,1 . 10-31 kg |
|
Q1) Dans la représentation symbolique d'un atome:
les nombres de protons / nucléons / neutrons
|
|
Q2) Parmi les propositions suivantes, laquelle concernant l'atome est fausse:
le nombre de protons est toujours inférieur ou égal au nombre de nucléons
|
|
Q3) On considère un atome de sodium :
11 protons, 23 neutrons, 11 électrons
|
|
Q4) On considère un autre atome de sodium représenté par:
isotopes
|
|
Q5) Les atomes représentés par:
ont un noyau identique
|
RAPPEL DES DONNEES UTILES / FERMER LA FENETRE DES DONNEES
|
Q6) On considère un atome de lithium:
La charge du noyau de cet atome vaut:
0 C
|
RAPPEL DES DONNEES UTILES / FERMER LA FENETRE DES DONNEES
|
Q7) On considère un atome de lithium:
La charge de cet atome vaut:
0 C
|
RAPPEL DES DONNEES UTILES / FERMER LA FENETRE DES DONNEES
|
Q8) On considère un atome de lithium:
La masse du noyau de cet atome vaut:
6,68 . 10-27 kg |
|
Q9) On considère un atome de lithium:
La masse de cet atome vaut:
6,68 . 10-27 kg
|
|
Q10) La comparaison de la masse d'un proton à celle d'un électron se fait par le calcul du rapport:
Ce rapport a pour valeur:
5,45 . 10-4
|
|
Q11) L'isotope majoritaire de l'oxygène est symbolisé par : Un autre isotope de l'oxygène possède 7 neutrons. Sa représentation symbolique est donc:
|
|
Q12) On considère un atome d'argon (Z = 18). Laquelle des affirmations suivantes concernant la structure électronique de l'atome d'argon est fausse:
la couche M est interne
|
|
Q13) Une seule des affirmations suivantes concernant un atome d'hélium (Z = 2) est vraie. Laquelle ?
l'hélium est le composant majoritaire de l'atmosphère terrestre
|
|
|
Q14) Lorsqu'un atome gagne un ou plusieurs électrons, il devient
un cation, électriquement neutre
|
|
|
Q15) Lorsqu'un atome se transforme en un ion, l'atome et l'ion formé :
ne présentent aucune différence
|
|
Q16) L'élément chimique soufre (S) est caractérisé par Z = 16. L'ion sulfure stable issu de cet atome est donc : S2+ S+ S-
|
|
Q17) L'élément chimique aluminium (Al) est caractérisé par Z = 13. L'ion aluminium stable issu de cet atome est donc : Al 5+ Al 3+ Al +
|
|
Q18) Parmi les entités chimiques suivantes, laquelle ne constitue pas un corps simple:: Li Mg 2+ Cl -
|
Fin du QCM / Partie 1
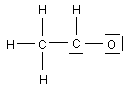
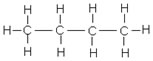 b°/
b°/ 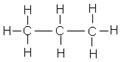 c°/
c°/ 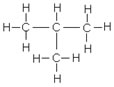 d°/
d°/